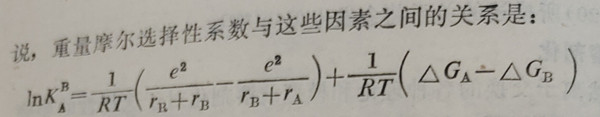選擇性的來源
同修 / 2022-07-04
6.4.2.2 選擇性的來源
目前情況下���,離子交換的理論不允許我們根據獨立的物理-化學數據來定量地預測離子對于離子交換劑的親和力�。不過��,決定選擇性的各種因素還是相當清楚的�。而且還發(fā)展了涉及各種模型的許多方法,將這些方法同半經驗的規(guī)則以及實驗所觀察到的相結合�,可以對離子對于某種給定離子交換劑的相對親和力做出符合邏輯的說明,有時甚至可以做出預測��。這些規(guī)則并不普遍適用��,通常它們只適用于有限數目的離子交換劑-離子體系���。既然這些半經驗規(guī)則及其概括只是依賴于離子或者離子交換劑的某些孤立的現(xiàn)象和性質��,所以定量地看���,所觀察到的選擇性與預測的選擇性仍會有所偏離,因為存在著兩種或兩種以上因素的競爭���,而只考慮了其中一種因素���。為此�,正確認識決定選擇性的所有各種可能因素有著極大的實際意義���。
反離子的電荷
正如在6.4.2.1節(jié)中所指出的,分離因子是在實驗條件下兩種反離子對于一種給定的離子交換劑的實際親和力的最好量度����。即使當離子交換劑對于某種給定離子是非選擇性的(Kg=1),根據式可清楚地看出��,只要p>q��,則Xbpaq>1�����,因為離子交換劑相的濃度通常是大于外部溶液的濃度(Q>C8)��。因此電荷較高的離子將被選擇性地吸著����,而且交換劑的交換容量越大����,外部溶液越稀時��,選擇性吸著也越強烈��。這種效應稱為“電選擇性”它與“真實”選擇性相反����,后者要求選擇性系數KBA不等于1。
對于痕量離子BP來說�,將式(微分可得到
將一種給定離子的分配系數的對數對支持電解應中主要離子濃度的對數作圖,每條曲線可有不同的斜率����,這依賴于有關的兩種高子的電荷比(圖6.9)。當支持電解質的濃度足夠高時會發(fā)生選擇性的逆轉��,即高電荷離子對于離子交換劑的親和力低于低電荷離子����。這種現(xiàn)象常被用于使各種元素以特定的順序從離子交換柱上洗脫。
在稀溶液中���,如同所預料的���,親和力的順序是La3+>Ca2+>Na+;SO24->Cl等�����。
如果離子交換劑中僅含少數功能團����,而且彼此相距較遠���,那么式(6.20)所描述的關系將會發(fā)生偏離
離子的溶劑化
雖然離子交換的各種理論和模型就溶劑化對于選擇性的影響問題有不同的解釋����,但有一點是一致的��,即離子溶劑化越甚��,離子對于離子交換劑的親和力就越小���。Gregor的理論認為離子交換劑相是一個有彈性的、可以伸張的聚合物網絡�����,上面帶著許多固定的功能團,功能團的電荷被可移動的反離子所抵消�。當與水接觸時,離子交換劑會溶脹���,聚合物網絡膨脹��,施加在內部溶液(離子交換劑相)上的壓力增大����。平衡時�����,離子交換劑相內部的滲透壓等于拉長的碳氫鏈施加在內部溶液上的壓力����。根據這一模型可以導出如下的重量摩爾選擇性系數關系式:
式中T是溶脹壓力,V和Vs是水合離子A9和BP的偏重量摩爾體積���。
Gregor的理論可以解釋許多簡單的實驗事實��,例如堿金屬對于磺酸型陽離子交換劑的親和力順序(選擇性順序):Cs+>Rb+>K+>Na+>Li+�,以及堿土金屬的類似順序:Ba2+>Sr2+>Ca2+>Mg2+等����。但是它不能解釋當X值比較高時可能會發(fā)生的選擇性逆轉現(xiàn)象�����;不能解釋對于相同結構但不同交聯(lián)度的離子交換劑����,logKab~XB曲線有交叉�����;也不能解釋選擇性與這一規(guī)則的明顯偏離�,在陰離子交換劑的情況下尤其如此。
根據Eisenman的理論��,應該從離子與離子交換劑動能團之間的靜電作用以及從與下述過程有關的能量中去尋找選擇性的原因�。這個過程是:由于反離子進入離子交換劑相�,水分子將從反離子的配位殼層中脫離(或重排)。對于一價離子的交換來說���,重量摩爾選擇性系數與這些因素之間的關系是:
式中s是電子的電荷����;Rr是功能團的半徑;Ra和Rb是反離子的結晶學半徑�,△Ga和△Gb是當離子從溶液中進入離子交換劑相時,假定發(fā)生的脫水過程的自由能����,其數值可以根據這些離子的已知水化估計。
Gregor的理論是假定進入離子交換劑相的離子保持其水化殼層實際上不受影響��,并根據水化離子的體積差異去尋求對于選擇性的解釋����。與Gregor的理論不同,由Eisenman提出并經Rei-chenberg改進的理論強調了溶劑化過程所伴隨的能量變化�����。根據這種理論���,從溶液中進入到離子交換劑相并受到功能團吸引的離子會從它的水化層中失去一些水分子����。
如果式(6.22)中的第一項是小的(當功能團半徑rn較大時就是這種情況�,例如一SO。基團)����,則選擇性系數由被交換離子的脫水自由能之差決定。脫水自由能越小��,該種離子的離子交換親和力就越大��。因此��,這一理論能對觀察到的堿金屬與磺酸型陽離子交換劑的親和力順序(Cs+>K+>Na+Li+)作出解釋��,同時也可能解釋陰離子交換劑的實驗結果�,例如選擇性順序CIO4->I->Br->CI-等。
但是應該記住�����,當n小時����,靜電作用能(式中的第一項)可以對選擇性系數有相當大的��,甚至是決定性的貢獻�����。可以預料����,這時就可能會發(fā)生選擇性順序的“逆轉”,即Li+>Na+>K+>Cs+�����。酸型離子交換劑實際上正是這種情況��。

.jpg)
.jpg)
.jpg)