- 初步認識碳是什么

- 初步認識碳是什么��,碳是構(gòu)成一切動植物體的重要元素.許多以動植物為來源的東西,在高溫的時侯都會分解成炭.,例如,燒飯或烙餅的時候,如果用火太猛,飯或餅有時會燒焦成一層黑色的炭:許多油類燃燒的時候,如果空氣不夠充分,常有很濃的黑煙冒出
- 磷酸和磷酸鹽,磷肥是什么化學(xué)特性

- 磷酸和磷酸鹽,磷肥是什么化學(xué)特性:磷酸是無色透明的晶體,易溶于水.通常所用的磷酸是一種含酸70~80%的糖漿狀溶液,工業(yè)上制取磷酸是用磷酸鈣(象纖核磷灰石)跟硫酸共熱,反應(yīng)如下
- 堿類、酸類和鹽類的電離劃分概念

- 堿類�����、酸類和鹽類的電離劃分概念:堿類��、酸類和鹽類都是電解質(zhì),它們在水里都能電離生成自由離子.但是堿堿類�、酸類和鹽類是不同種類的電解質(zhì),它們在水溶液里電離生成的離子當(dāng)然也是不同的.在本節(jié)里,我們將討論這幾類電解質(zhì)在水溶液里的電離,從而進一步從本質(zhì)上來認識它們的性質(zhì)�����。
- 離子的化學(xué)物理性質(zhì)是什么
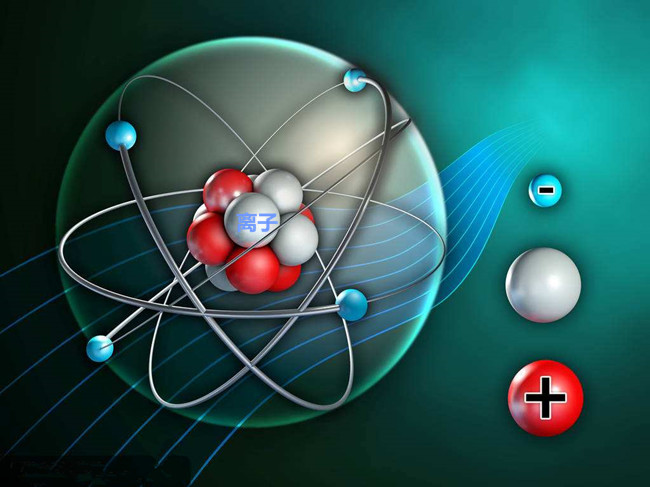
- 離子的化學(xué)物理性質(zhì)是什么���,電解質(zhì)的分子在一定條件下能夠電離成帶電荷的離子,離子就是帶正電荷或負電荷的原子(或原子團)
- 金屬��、非金屬和惰性氣體的區(qū)別

- 金屬��、非金屬和惰性氣體的區(qū)別�����,金屬和非金屬不僅物理性質(zhì)不同,它們的化學(xué)性質(zhì)也不同.大部分的金屬和非金屬都能在一定條件下和氧化合生成氧化物,但金屬的氧化物和非金屬的氧化物的性質(zhì)是不同的關(guān)于這個問題,我們將在本章第7節(jié)里詳細討論.
- 氧化物的性質(zhì)用途及分子式

- 氧化物的性質(zhì)用途及分子式����,氧化物的存在和用途 我們已談到了氧化物,在自然界里,氧化物是廣泛地存在著的.水是地球上分布最廣的氧化物,在大氣里含有的二氧化碳,以及構(gòu)成砂礫���、石英�����、瑪璲等的主要成分二氧化硅都是氧化物,蘊藏在地下的許多金屬礦石,例如赤鐵礦(Fe2O3)����、磁鐵礦(Fe3O4)�、赤銅礦(Cu2O)、黑銅礦(CuO)�����、鋁礬土礦(Al203)等的主要成分也都是氧化物
- 堿的種類及其定義

- 堿的種類及其定義,幾種重要的堿堿金屬氧化物能直接或間接生成它們相應(yīng)的水化物,大部分金屬氧化物的水化物都屬于“堿類”,現(xiàn)在先介紹幾種重要的堿�。
- 酸的種類及其性質(zhì)

- 鹽酸(HC1)鹽酸是一種叫做氯化氫(HCI)氣體的水溶液,濃鹽酸里含有37%的氯化氫.純凈鹽酸是無色的液體,工業(yè)上用的粗鹽酸因含有雜質(zhì)(主要是鐵的化合物)而顯黃色,鹽酸是一種揮發(fā)性酸,打開盛裝濃鹽酸的瓶蓋,就可聞到股刺激性的氣味,在瓶口還冒出白色的霧.這是因為從鹽酸里逸出的氯化氫氣體,溶解在瓶口附近空氣的水蒸氣里里,生成許多微小的鹽酸酸滴,形成一團團白色的酸霧
- 酸堿中和反應(yīng)測土壤酸堿性
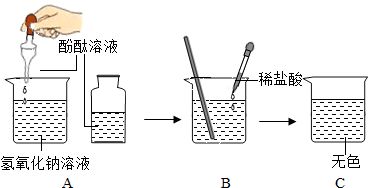
- 酸堿中和反應(yīng)測土壤酸堿性,前面我們曾談到,酸酸和堿相互反應(yīng)生成鹽和水是一切酸���、堿普遍具有的重要化學(xué)性質(zhì)之當(dāng)我們所用酸����、堿的量剛好完全反應(yīng)時,最后所得溶液里既沒有過剩的酸也沒有過剩的堿存在,這時溶液就不會顯出酸的性質(zhì)也不會顯出堿的性質(zhì).如果我們用紅色石蕊試紙去試驗,不會變藍(因為溶液里沒有過剩的堿);用藍色石蕊試紙去試驗,不會變紅(因為溶液里沒有過剩的酸).這時,我們說酸和堿是完全相互中和了①,因此,我們把酸和堿相互反應(yīng)生成鹽和水的反應(yīng)稱為酸堿中和反應(yīng),或簡稱中和反應(yīng).中和反應(yīng)是屬于復(fù)分解反應(yīng)類型的
- 氧化物的分類及其性質(zhì)

- 我們已知道,大部分的氧化物都有相應(yīng)的水化物存在,但有些氧化物(主要是金屬的氧化物)的水化物是屬于堿類的物質(zhì),另一些氧化物(主要是非金屬的氧化物)的水化物是屬于酸類的物質(zhì).在前面談到酸��、堿的化學(xué)性質(zhì)時,我們曾談到酸能和某些氧化物(主要是金屬的氧化物)反應(yīng)生成鹽和水;堿能和另一些氧化物(主要是非金屬的氧化然物)反應(yīng)生成鹽和水.現(xiàn)在我們們根據(jù)這些不同的性質(zhì),把氧化物分成兩類






